Je décidai de trouver la solution à mes interrogations sur internet à l’aide de Google. C’est une astuce que j’utilise quand je cherche quelque chose sur internet, elle comporte les deux étapes suivantes:
Bien sûr, je pensais obtenir bien vite une réponse à mes questions grâce à des recherches bien ciblées, comme “acide inoffensif enfants” ou des “gravure cuivre buvable” ou autre. Je déchantai aussi sec, parce que je pensais tomber sur tout un tas de forums où j’aurai trouvé une idée inattendue mais qui marche bien.
A vrai dire je comptais un peu sur ça:

Mais je tombais surtout sur ça:

J’allais laisser tomber lorsque je tombai sur des forums de types qui gravent eux-mêmes leurs circuits électroniques, certains avec de l’acide et d’autres avec un courant électrique. Genre les mecs, direct: l’électrolyse.
Qu’est-ce que l’électrolyse ?
L’électrolyse, c’est une façon électrique de retirer des petits bouts de trucs à un métal pour que ça aille se mettre sur un autre métal. Ca sert à plein de trucs super, comme dérouiller des clous rouillés, ou plaquer des trucs moche avec de l’or pour qu’ils soient plus jolis, ou plein d’autres trucs, par exemple la gravure.
J’ai élaboré DEUX règles simples pour que tout le monde s’y retrouve:

Règle n°1
Regardez ça. Dès qu’on branche la pile, les petits atomes d’un bout de métal se sauvent en nageant et ils vont se coller sur l’autre bout de métal qui trempe dans le liquide ! Il y a rien d’autre à faire !

Alors oui, les gens un peu tatillons me feront remarquer qu’on est pas chez oui-oui et que l’électrolyse c’est ça:
La matière à décomposer ou à transférer est dissoute dans un solvant approprié, ou fondue de sorte que ses ions constitutifs soient disponibles dans la solution.
Une différence de potentiel électrique est appliquée entre deux électrodes immergées dans cette solution.
La cathode est le siège d’une réduction et, l’anode le siège d’une oxydation. Le potentiel de l’anode étant supérieur -ou égal dans une pile court circuitée- au potentiel de la cathode on peut dire que l’anode est la borne positive et que la cathode est la borne négative. Notons que ces bornes sont inversées dans le cas d’une pile.
Lors du passage d’un courant électrique continu, les électrodes attirent à elles les ions de charge opposée. Mais il est faux de dire que l’électrolyse se résume à l’oxydation des anions à l’anode et à la réduction des cations à la cathode. En effet, il est aussi possible d’oxyder des cations à l’anode.
Je vous jure que j’invente rien, c’est copié-collé de wikipedia.
Alors excusez-moi les mecs mais j’ai rien compris, alors que ma règle n°1 est bien plus simple.
Concrètement, comment ça se goupille ?
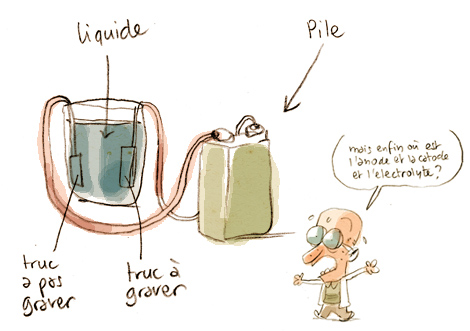
Vous avez remarqué le petit bonhomme tatillon de tout à l’heure qui revient avec ses termes compliqués ?
Il revient parce qu’il veut savoir exactement sur quel bout brancher sa pile pour que ça marche bien ! Hihi !
C’est pour ça que j’ai élaboré la règle n°2, pour savoir sur quel fil brancher quel bout de la pile ! Quand la réaction commence, il y a un des deux bouts de métal qui va faire des bulles.

Le liquide dans lequel baignent les deux bout de métal doit être spécial (c’est ce que le bonhomme appelle “électrolyte”). Pour le cuivre, c’est de l’eau distillée avec du sulfate de cuivre. C’est plus ou moins de la bouillie bordelaise, en gros. Restait à trouver du sulfate, et pour le coup j’ai eu du bol.
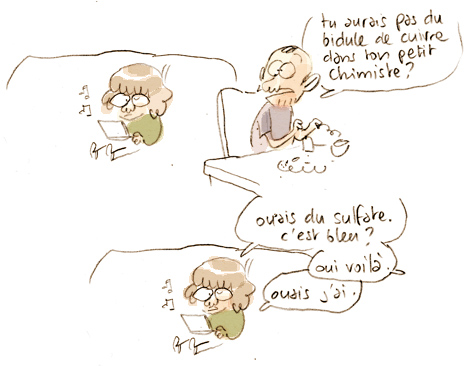
Ma fille a une boite de petit chimiste.
Voilà, il me restait à mettre tout ça en pratique, la prochaine fois on revient à la gravure.














 Une bacchanale, par moi.
Une bacchanale, par moi.

 Dürer: un feu d’artifice d’émotions.
Dürer: un feu d’artifice d’émotions.

 “ahah lol”
“ahah lol”